
研究内容
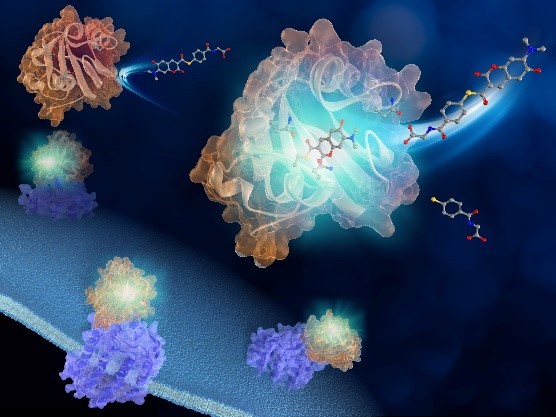
本研究室では、化学の原理を考案・応用することで、合成蛍光分子でタンパク質をラベル化・可視化するケミカルバイオロジーの技術を開発しています。細胞内には、無数の生体分子が存在し、ダイナミックにその局在を変化させ、必要とされる場所で機能を発揮することで細胞の生理機能を制御しています。その生体分子の動きを可視化することは、その分子の制御する生理機能を解明する重要な情報を与えてくれます。我々は、タンパク質を蛍光ラベル化する独自の技術を開発し、生細胞の中でタンパク質がいかにして動き、生命現象を制御しているかを明らかにします。さらには、そのタンパク質ラベル化技術を駆使して、タンパク質に加え、核酸や糖鎖、細胞外小胞の制御する生命現象を解明するとともに、生体分子の機能を自在に制御することを目指しています。
PYPタグと合成蛍光プローブを用いたタンパク質ラベル化技術の開発
タグタンパク質と合成蛍光プローブを利用したタンパク質標識法は、化学を基盤とする新しいイメージング技術として近年脚光を集めています。この技術では、標的タンパク質に融合させたタグタンパク質を合成蛍光プローブにより特異的に標識することで、標的タンパク質の動態を可視化できます。この技術は、パルスチェイス実験による高精度なタンパク質動態の時空間解析を可能にするとともに、超解像イメージングにも応用されています。
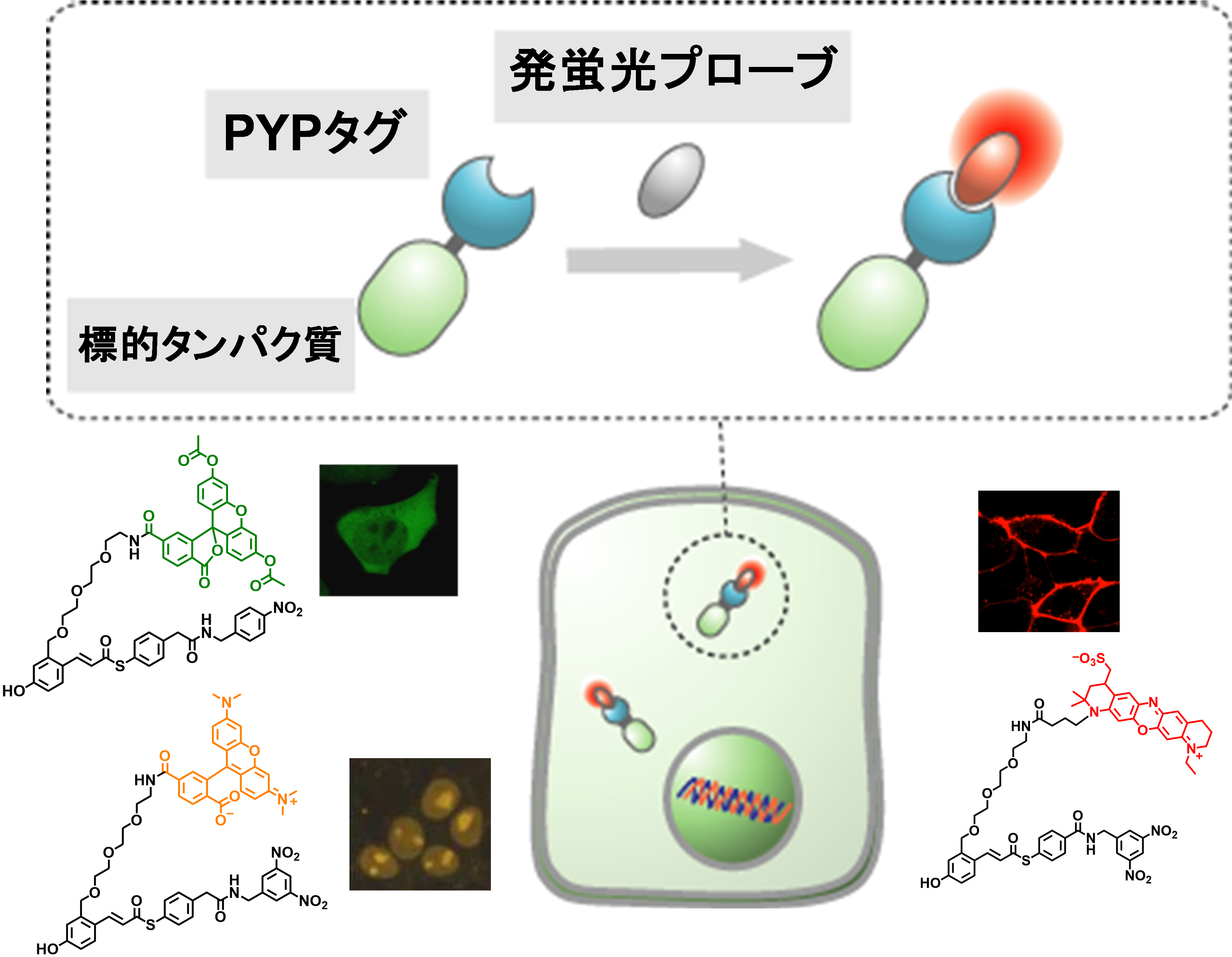
一方、通常のプローブは、常に蛍光を発しているため、プローブを細胞に添加してそのまま顕微鏡で観察すると、遊離プローブの蛍光がバックグラウンドシグナルとなり、標的タンパク質の検出に問題を与えます。我々は、この課題を解決するために、PYPタグという独自のタグタンパク質とラベル化反応に伴い蛍光性となる「発蛍光プローブ」を用いたタンパク質ラベル化技術を開発してきました。この技術を応用することで、エピジェネティクスや免疫応答、細胞のガン化などに関わる様々なタンパク質の動態の可視化を行ってきました。現在、より高速・高コントラストにタンパク質をイメージングできる蛍光プローブ開発を行っています。
【参考文献】1. J. Am. Chem. Soc. 2009, 131, 16610. / 2. Angew. Chem. Int. Ed. 2012, 51, 5611. / 3. J. Am. Chem. Soc. 2013, 135, 12360. / 4. Angew. Chem. Int. Ed. 2015, 54, 14368. / 5. Chem. Sci. 2016, 7, 308. / 6. Chem. Sci. 2020, 11, 3694–3701.
タンパク質ラベル化技術によるGLUT4の動態制御機構の解明
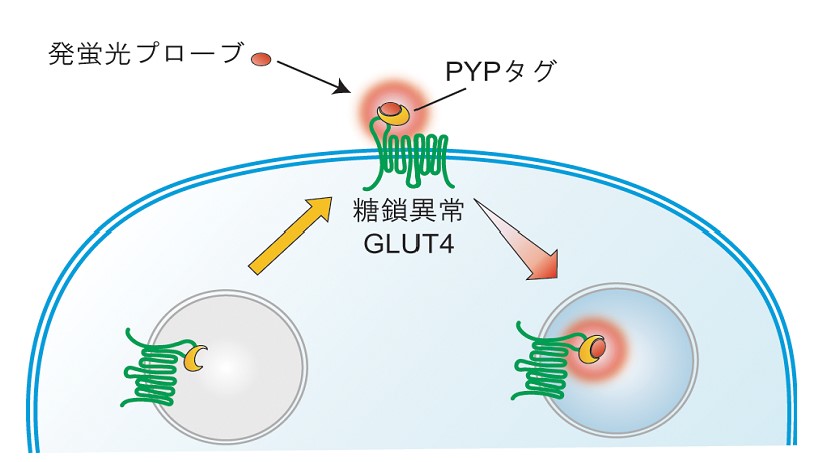
グルコーストランスポーターの一種であるGLUT4は、血中グルコースを細胞内に取り込むことで、血糖値を低下させる重要な役割を果たしています。GLUT4は、通常は細胞内に存在しますが、インスリン刺激により細胞膜へ移行しグルコースを取り込むことが知られています。一方、インスリン抵抗性を示す2型糖尿病患者では、GLUT4の細胞膜移行が起こりにくくなり、効率的にグルコースを細胞内に取り込むことができません。このため、GLUT4の動態制御機構の解明は、糖尿病の発症機構の解明や治療のうえで極めて重要な課題となっています。近年、GLUT4に付加される糖鎖が、GLUT4の細胞内動態において果たす役割に注目が集まっています。我々は、タンパク質ラベル化技術を用いることで、GLUT4の細胞膜移行を可視化し、糖鎖がGLUT4を細胞膜に引き留める役割を果たしていることを見出しました。現在、糖尿病治療に役立つ知見を得るべく、糖鎖がGLUT4の動態を制御する機構の詳細を明らかにする研究を行っています。
【参考文献】1. Nat. Chem. Biol. 2016, 12, 853. / 2. Chem. Lett. 2020, 49, 232.
タンパク質の分解を可視化する蛍光プローブの開発
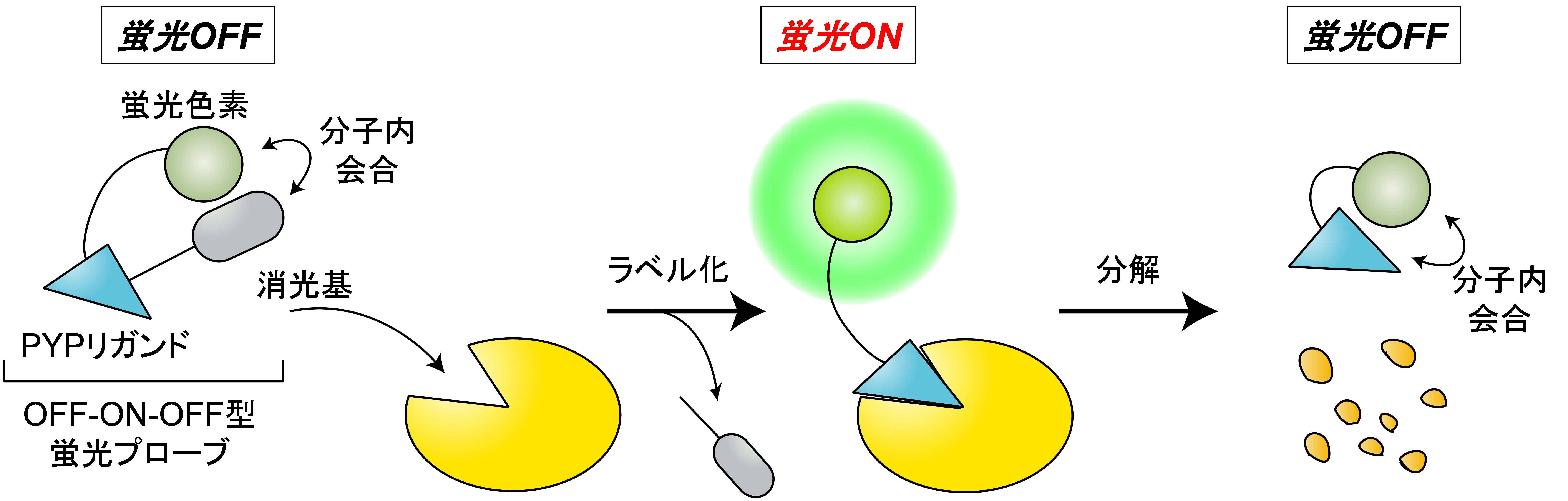
タンパク質の分解は、栄養環境の維持や異常タンパク質の除去に加え、細胞のシグナル伝達や細胞周期の制御においても極めて重要な役割を果たしています。タンパク質の発現と分解のバランスの異常は、癌や神経疾患の原因となることが知られています。また、タンパク質の分解を人為的に誘導する化合物が新たな医薬品として大きな期待を集めています。このため、タンパク質の分解を生細胞で可視化することは、タンパク質分解機構に関する有用な情報を提供するとともに、医学や創薬の新たなツールとなることが期待できます。我々は、遊離状態では非蛍光性で、タンパク質をラベル化すると蛍光性となり、タンパク質が分解されると蛍光強度が再び低下する、「OFF-ON-OFF型蛍光プローブ」を開発し、タンパク質の分解を可視化することに成功しています。現在、更に高感度にタンパク質の分解を検出できる技術開発を行っています。
【参考文献】1. Bioconjug. Chem. 2020, 31, 577–583. / 2. Chem. Sci. 2022, 13, 1419.
ハイブリッドプローブによる核酸修飾の可視化
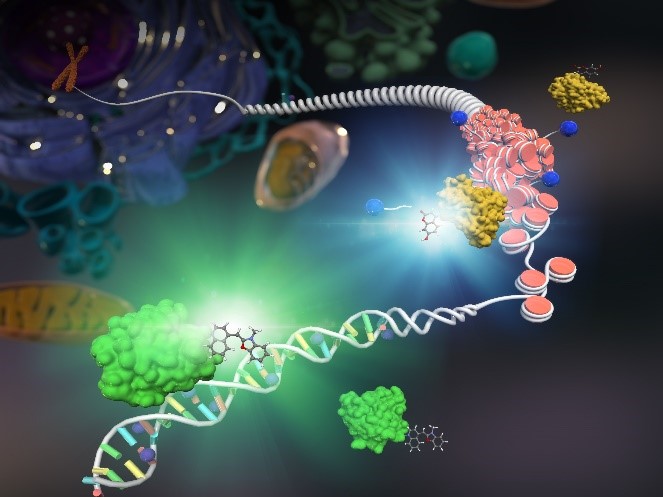
エピジェネティクスは、DNAの塩基配列によらずに遺伝子発現を制御する仕組みであり、近年大きな注目を集めています。特に、DNAメチル化は、エピジェネティクス機構における代表的な化学修飾の一つであり、その異常は、癌や免疫疾患などの様々な原因となることが知られています。このため、生命科学のみならず医学・創薬の分野で、その機構解明が重要視されています。これまでに、メチル化DNAを解析する方法として、細胞をすりつぶす生化学的手法が多数報告されています。一方、生細胞の状態で解析する方法の開発は、DNAメチル化のダイナミクスを明らかにするうえで極めて有用でありますが、その方法は蛍光タンパク質を用いた方法に限られています。我々は、タンパク質ラベル化技術を応用することで、合成色素とタンパク質からなるハイブリッドプローブを細胞内で構築しました。このハイブリッドプローブは、メチル化DNAに特異的に結合し、その結合に伴い蛍光強度を上昇させる機能を持っています。このハイブリッドプローブによりメチル化DNAの生細胞における動態を可視化することに成功しました。DNAのメチル化以外にも、多様な核酸の化学修飾が知られているものの、その細胞内動態や機能には多くの解明すべき課題が存在します。このため、現在では、ハイブリッドプローブ技術を発展させて、それらの核酸の化学修飾の可視化とその機能の解明を可能とする技術の開発に取組んでいます。
【参考文献】1. J. Am. Chem. Soc. 2018, 140, 1686. / 2. Acc. Chem. Res. 2019, 52, 2849–2857.
超解像イメージングを志向した蛍光スイッチングプローブの開発
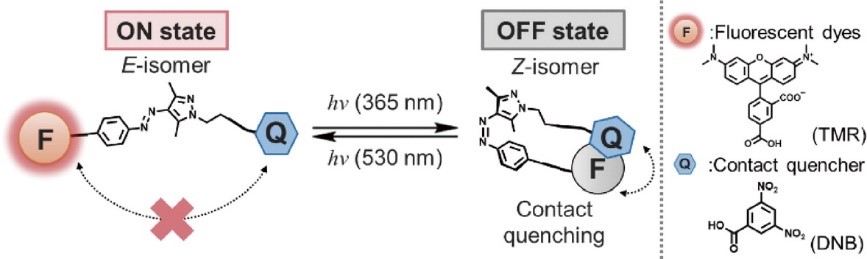
光により蛍光強度をOFF-ONできる蛍光スイッチング分子は、超解像顕微鏡で生体分子の動態を可視化する強力なツールとなります。特に、光褪色せず、可視光のみで蛍光強度を制御できる分子は、長時間の超解像イメージングを可能とするため、そのニーズは極めて大きいといえます。一方、これまでに、蛍光タンパク質や合成蛍光色素を改変した蛍光スイッチング分子が開発されてきましたが、光褪色しやすいことや細胞毒性があるなどの問題があり、超解像技術の発展を大きく制限している状況です。我々は、この問題を解決するために、フォトクロミック分子を利用・改変し、新たなコンセプトに基づいた蛍光スイッチング分子を開発します。
【参考文献】Bull. Chem. Soc. Jpn. 2022, 93, 821.
page top
